ЦЕРЕБРАЛЬНЫЕ ОРГАНОИДЫ: МОДЕЛЬ РАЗВИТИЯ МОЗГА
←
→
Транскрипция содержимого страницы
Если ваш браузер не отображает страницу правильно, пожалуйста, читайте содержимое страницы ниже
ОНТОГЕНЕЗ, 2020, том 51, № 4, с. 275–291
ОБЗОРЫ
УДК 576.08
ЦЕРЕБРАЛЬНЫЕ ОРГАНОИДЫ: МОДЕЛЬ РАЗВИТИЯ МОЗГА
© 2020 г. К. К. Сухиничa, *, М. А. Александроваa
a
ФГБУН Институт биологии развития им. Н.К. Кольцова РАН, ул. Вавилова, 26, Москва, 119334 Россия
*e-mail: transpl@hotmail.com
Поступила в редакцию 01.03.2020 г.
После доработки 30.03.2020 г.
Принята к публикации 31.03.2020 г.
На данный момент развитие человеческого мозга в норме и при патологии не может быть полно-
стью воспроизведено на животных моделях, что ведет к необходимости поиска альтернативных ре-
шений. За последние годы были достигнуты значительные успехи в разработке методов культиви-
рования церебральных органоидов мозга человека. Церебральные органоиды представляют собой
3D культуры, в которых развиваются специфичные для мозга типы клеток, полученные из эмбрио-
нальных или индуцированных плюрипотентных стволовых клеток. В церебральных органоидах,
благодаря самоорганизации нервной ткани, воспроизводятся уникальные особенности развития
человеческого мозга, которые отсутствуют в развивающемся мозге грызунов. Однако они не явля-
ются точной копией, поэтому преодоление ряда ограничений в будущем расширит наши возмож-
ности исследовать развитие и нарушения мозга человека. Очевидно, что уже в настоящее время мо-
делирование церебральных органоидов открывает перспективы как для фундаментальных, так и
клинических исследований. В настоящем обзоре мы обсуждаем методы культивирования нервной
ткани, способы получения церебральных органоидов, особенности их самоорганизации, моделиро-
вание в них процессов нормального развития и патологии мозга.
Ключевые слова: церебральные органоиды, 3D культуры, развитие мозга, нейрогенез, радиальная
глия человека
DOI: 10.31857/S0475145020040072
ВВЕДЕНИЕ. ОБОСНОВАНИЕ РАЗРАБОТКИ (Lui et al., 2011). Так, в развивающейся коре мозга
АДЕКВАТНЫХ МОДЕЛЕЙ ДЛЯ ИЗУЧЕНИЯ человека формируется обширная внешняя суб-
РАЗВИТИЯ МОЗГА ЧЕЛОВЕКА вентрикулярная зона (вСВЗ), которая отсутствует
И РОЛЬ 3D ОРГАНОИДОВ у мышей (Hansen et al., 2010). В этой зоне распо-
Изучение развития мозга в норме и при пато- ложены клетки внешней радиальной глии (вРГ),
логии является одной из ключевых задач нейро- отличные от других клеток радиальной глии по
биологии. Формирование мозга человека пред- поведению и экспрессии ряда специфических для
ставляет собой особую проблему, решение кото- человека генов (Taverna et al., 2014; Pollen et al.,
рой ограничивается не только сложностью его 2015; Florio et al., 2015, 2018). Клетки вРГ из вСВЗ
морфо-функциональной организации, отличаю- генерируют огромный пул нейронов, за счет ко-
щейся от приматов и грызунов, но и набором до- торого значительно увеличиваются размеры коры
пустимых методов и животных модельных систем и обеспечивается ее гирификация (Sousa et al.,
для его исследования (Fietz, Huttner, 2011; Taverna 2017; Bershteyn et al., 2017). Они имеют характер-
et al., 2014; Florio et al., 2018). ные особенности в пролиферации (Homemet al.,
Среди экспериментальных млекопитающих 2015), а их клеточный цикл может регулироваться
широко используют лабораторных грызунов, в уникальными для приматов микроРНК, участву-
частности мышей, на которых установлены базо- ющими в контроле уровня пролиферации (Nowa-
вые механизмы ранних этапов развития мозга. Ге- kowski et al., 2018; Prodromidou, Matsas, 2019). Кроме
нетические манипуляции с геномом мыши в по- структурно-морфологических различий, известно,
следние годы стали очень эффективными и слож- что эволюционно наиболее новая фронтополярная
ными, но во многих случаях прямой анализ область коры мозга человека претерпела суще-
человеческих тканей оказывается предпочтитель- ственные изменения, затрагивающие более 5% ее
нее, чем изучение модели на грызунах, поскольку, транскриптома в сравнении с близкими примата-
несмотря на эволюционную консервативность, ми, не говоря уже о грызунах (He et al., 2017). В до-
развитие мозга мышей отличается от человека полнение к этому, в мозге человека типы астроци-
275276 СУХИНИЧ, АЛЕКСАНДРОВА
тарных клеток морфологически и функциональ- Однако нужно обратить внимание, что термин
но намного сложнее, чем у грызунов (Oberheim “органоид” до сих пор не имеет четкого определе-
et al., 2009). Эти фундаментальные отличия ста- ния и его трактовка различается в зависимости от
вят вопрос о поиске адекватных моделей для изуче- экспериментального контекста. Одни исследовате-
ния механизмов раннего развития мозга человека и ли называют органоидами структуры “напоминаю-
его заболеваний. Новые модели необходимы и для щие органы”, возникающие при агрегации клеток,
клинически направленных исследований лекар- другие, – клеточные комплексы, образующиеся из
ственных препаратов, потому что использование в коммитированных эмбриональных стволовых кле-
доклинических анализах экспериментальных жи- ток при реализации эндогенной генетической про-
вотных, зачастую не позволяет адекватно спрогно- граммы (Simian, Bissell, 2017). По мнению Сасаи,
зировать, какие препараты и методы будут эффек- органоид должен иметь: трехмерную структуру из
тивны, так как около 80% новых лекарственных клеток, которые устанавливают или сохраняют
средств, прошедших испытания на животных, у че- морфологическую идентичность моделируемого
ловека терпят неудачу (Perrin, 2014; Mak et al., органа; разнообразие типов клеток, как в самом
2014). органе, проявляющих некоторые специализиро-
ванные функции органа и, наконец, самооргани-
Одним из подходов к решению комплексной
зация органоида должна соответствовать тем же
проблемы моделирования развития мозга челове-
внутренним организационным принципам, что и
ка может быть применение методов культивирова-
в самом органе (Sasai, 2013).
ния клеток. На данный момент широко распро-
страненным методом является двумерное (2D), ад- В настоящем обзоре мы суммировали данные
гезивное культивирование клеток, которое имеет по методам культивирования нервной ткани, их
преимущества в том, что культура легко масштаби- возможности и ограничения; способы получения
руется; клетки обеспечиваются равномерным до- церебральных органоидов из стволовых клеток и
ступом к факторам среды, сохраняется относи- особенности их самоорганизации, клеточные ха-
тельно однородная популяция клеток, что помо- рактеристики церебральных органоидов и модели-
гает проводить экспериментальные воздействия, рование в них процессов нормального развития и
анализировать клетки и визуализировать их в ре- патологии мозга, структурные и молекулярные
альном времени (Koo et al., 2019). Однако такая свойства разных нейральных органоидов in vitro и
система имеет и ряд недостатков, ограничиваю- in vivo, и перспективы их использования in vivo.
щих изучение развития нервной ткани (Hong, Do,
2019; Pacitti et al., 2019). При 2D культивировании КУЛЬТИВИРОВАНИЕ НЕРВНОЙ ТКАНИ:
не достаточно реализуются специфические взаи- ОТ 2D К 3D КУЛЬТУРАМ
модействия между разными типами клеток и
клетками и внеклеточным матриксом, которые История культивирования нейральных тканей
определяют и регулируют важные морфогенети- насчитывает уже более 100 лет. Первая культура
ческие этапы развития in vivo. Например, в этой была получена в 1907 году Харрисоном (Harrison,
системе отсутствует пространственный градиент 1907), который обнаружил рост нейритов нерв-
факторов, имеющих решающее значение для ре- ных клеток от кусочков нервной трубки лягушек,
гиональной спецификации мозга; нарушаются сохраненных в капле лимфы на протяжении 4 не-
характерная клеточная полярность и миграция дель. Фрагменты тканей нервной системы челове-
клеток. Но главное, что в 2D культуре не форми- ка научились культивировать значительно позд-
руется трехмерная организация нервных и гли- нее, в 40-е годы, используя хорошо зарекомендо-
альных клеток и специфические пространствен- вавший себя метод висячей капли и новый метод
ные межклеточные взаимодействия характерные роллерного культивирования (Hogue, 1946). Через
для развивающегося мозга in vivo. Из сказанного 10 лет удалось получить первую монослойную
следует, что необходимо искать пути для про- культуру энзиматически диссоциированных кле-
странственного воспроизведения процессов раз- ток из спинного мозга эмбриона цыпленка (Cava-
вития и организации нервной ткани в условиях naugh, 1955). Затем Москона вырастил агрегаци-
трехмерного микроокружения. И здесь интерес- онную культуру клеток из ткани эмбрионов мы-
ным может быть создание трехмерных органои- шей, где было показано, что диссоциированные
дов в системе 3D культивирования, где, как пра- клетки способны реагрегировать и образовывать
вило, клетки имеют более высокую скорость про- тканеподобные структуры (Moscona, 1961).
лиферации, чем в монослойных культурах, и их Одновременно с этими исследованиями в ней-
дифференцировка более близка к той, что наблю- робиологии произошло принципиально важное
дается in situ. Церебральные органоиды часто открытие, не замеченное в то время, но имевшее
определяют, как органоподобные 3D культуры, чрезвычайно важные последствия. В середине
состоящие из специфичных для мозга типов кле- 60-х годов прошлого века Дж. Альтман и Г. Дас
ток, полученных из плюрипотентных стволовых обнаружили возникновение новых нервных кле-
клеток (Lancaster, Knoblich, 2014; Qianetal., 2019). ток в мозге у взрослых грызунов (Altman, Das,
ОНТОГЕНЕЗ том 51 №4 2020ЦЕРЕБРАЛЬНЫЕ ОРГАНОИДЫ: МОДЕЛЬ РАЗВИТИЯ МОЗГА 277
1965). Несмотря на доказательство (методом ав- дифференцировок (Ying et al., 2003; Chambers et al.,
торадиографии) нейрогенеза в субвентрикуляр- 2016) или, например, при использования noggin
ной зоне (СВЗ) боковых желудочков и субграну- для блокирования BMP4 (Itsykson et al., 2005; Ger-
лярной зоне зубчатой извилины гиппокампа (Al- rard et al., 2005; Eiraku et al., 2008). Наряду с этим,
tman, Das, 1965; Altman, 1969), их открытие не многие авторы отмечают интересный и важный
было востребованным вплоть до 90-х годов, до факт, что ЭСК мыши и человека в культуре могут
момента, когда клетки нейрогенных зон поме- пойти по нейральному пути развития даже в от-
стили в культуру. Работа с культурой привела к сутствие внешних сигналов (Tropepe et al., 2001;
пониманию того, что нейрогенез в мозге поддер- Muñoz-Sanjuán, Brivanlou, 2002; Smukler et al.,
живается за счет особых нейральных стволовых 2006). Естественно возникает вопрос, за счет ка-
клеток (НСК), способных к самоподдержанию и ких факторов происходит нейрализация клеток?
дифференцировке во все основные типы клеток Частично ответ на него был найден при изучении
нервной системы (Reynolds, Weiss, 1996). Иссле- ключевых для развития нервной ткани морфоге-
дование показало, что клетки из СВЗ мышей (в нов (Bertacchi et al., 2015). Оказалось, что мЭСК
среде без сыворотки, с добавками bFGF и EGF) нейрализуются и самостоятельно паттернируют-
образуют в культуре свободноплавающие округ- ся за счет эндогенного повышения экспрессии
лые агрегаты – нейросферы. Их клетки могли, WNT, FGF и BMP (дорзо-каудальная ось), и низ-
как формировать новые нейросферы, так и диффе- кого уровня экспрессия лигандов Activin/Nodal и
ренцироваться в нейроны, астроциты и олигоденд- Shh (вентральная ось). Можно предположить, что
роциты, что доказывало их стволовые свойства благодаря градиенту морфогенов, нейральные
(Reynolds, Weiss, 1996). Суммарно, способность клетки самоорганизуются и формируют округлые
клеток к формированию нейросфер, самоподдер- структуры из полярных нейроэпителиальных
жанию и дифференцировке была положена в опре- клеток, которые при адгезии на пластике образу-
деление термина – нейральная стволовая клетка. ют нейроэпителиальные розетки (Zhang et al.,
Первые мультипотентные НСК человека были 2001; Gerrard et al., 2005; Elkabetz, Studer, 2008).
получены из мозга эмбриона 10.5 недель развития Розетки формируются клетками с четкой апико-
в 1999 году (Vescovi et al., 1999). Способные к са- базальной ориентацией, которые располагаются
мообновлению и длительному сохранению в апикальным концом с ресничкой внутрь цен-
культуре НСК дали возможность исследовать тральной полости, а базальным концом наружу,
определенные этапы развития мозга и моделиро- что в целом напоминает фронтальный срез нерв-
вать некоторые заболевания in vitro (Carpenter et al., ной трубки с желудочком посередине. Как и при
1999). Здесь интересно вспомнить о наших рабо- нормальном развитии, нейроэпителиальные клет-
тах проведенных ранее. Анализируя морфологию ки из ЭСК пролиферируют, формируют подобие
и клеточный состав нейросфер из НСК от эмбри- вентрикулярной и субвентрикулярной зоны, где
онов человека in vitro и после их трансплантации они дифференцируются в радиальную глию (РГ).
в мозг крыс, в ряде случаев мы обнаружили, что Для нее характерно плотное близко друг к другу
внутри сфер формировались четко организован- расположение клеточных тел, имеющих радиаль-
ные розетки клеток, напоминающие нейроэпите- но отходящий длинный базальный отросток, рас-
лиальные структуры, о которых речь пойдет ниже тущий по мере увеличения мозга. Радиальная
(Podgornyi et al., 2005; Aleksandrova et al., 2006). глия генерируют практически все нейроны и
глию мозга, одновременно играя роль стволовых
Несмотря на интерес исследователей к анали- клеток (материнских) и рельсов, направляющих
зу нейросфер, их редко используют для изучения миграцию новорожденных клеток (Zhang et al.,
ранних этапов развития мозга человека, что глав- 2001; Campbell, Götz, 2002; Fietz, Huttner, 2011;
ным образом, связано с этическими требования- Taverna et al., 2014). В органоидах митозы РГ про-
ми, и особенностями их культивирования. Ней- исходят в апикальной части клетки, куда опуска-
росферы трудно длительное время сохранять в ется ядро при делении, при этом материнская
культуре, они адгезируют, а их клетки хаотично клетка сохраняет длинный отросток, а дочерняя
мигрируют и не образуют упорядоченной струк- клетка мигрирует вдоль отростка. Этот алгоритм
туры (Eiraku et al., 2008; Lancaster, Knoblich, 2014). точно повторяет нормальное развитие эмбриона
Методологические изменения произошли в (Curchoe et al., 2012; Ziller et al., 2015; Edri et al.,
конце 90-х, когда в дополнение к эмбриональ- 2015). На ЭСК были отработаны основные мето-
ным стволовым клеткам мыши (мЭСК) были по- дические приемы получения церебральных орга-
лучены эмбриональные стволовые клетки чело- ноидов, и многие исследования подтвердили, что
века (чЭСК), способные генерировать клетки in vitro можно создавать модели ранних этапов
всех зародышевых листков (Evans, Kaufman, 1981; развития мозга человека. Однако этические спо-
Thomson et al., 1998). Направление ЭСК по ней- ры о возможности использования эмбриональ-
ральному пути развития происходит при подавле- ных стволовых клеток, а главное получение инду-
нии индуктивных сигналов для альтернативных цированных плюрипотентных стволовых клеток
ОНТОГЕНЕЗ том 51 №4 2020278 СУХИНИЧ, АЛЕКСАНДРОВА
(ИПСК) сместили интересы исследователей в для самоорганизации. “Направленные” методы,
сторону ИПСК (Takahashi et al., 2007). Хорошо наоборот, основаны на изначальном использова-
известно, что данный тип клеток может быть по- нии внешних регуляторных факторов, чтобы на-
лучен как от здорового человека, так и больного править клетки дифференцироваться в желаемых
пациента, что открывает путь к изучению множе- нейральных направлениях (Qian et al., 2019; Koo
ства заболеваний и персонализированной меди- et al., 2019).
цине (Avior et al., 2016). Пионерские работы (Eiraku В основе одного из “направленных” базовых
et al., 2008; Mariani et al., 2012; Lancaster et al., 2013), в протоколов культивирования мЭСК и чЭСК ле-
которых были получены церебральные органоиды жит метод SFEBq (serum-free floating culture of
из разных ИПСК человека в 3D культуре, выделили embryoid body-like aggregates with quick reaggrega-
эти исследования в особое перспективное направ- tion) (Watanabe et al., 2005). Клетки культивируют
ление. с использованием среды с ингибиторами SMAD,
подавляя развитие мезодермы и энтодермы (Cham-
ТЕХНОЛОГИИ ПОЛУЧЕНИЯ bers et al., 2009), после чего нейральная дифферен-
ЦЕРЕБРАЛЬНЫХ ОРГАНОИДОВ цировка продолжается автономно (Eiraku et al.,
И ИХ МОРФО-ФУНКЦИОНАЛЬНЫЕ 2008). Общие принципы протокола заключались в
ХАРАКТЕРИСТИКИ следующем. Диссоциированные мЭСК (или чЭСК)
культивировали в 96 луночном низко адгезивном
Изначально ЭСК или ИПСК культивируют планшете с U-образными лунками, где через не-
для получения эмбриоидных тел, которые пред- сколько часов образовывались клеточные агрегаты,
ставляет собой многоклеточный агрегат, имею- подобные эмбриоидным телам, но в которых уже
щий ряд характеристик, аналогичных внутренней около 70% клеток были положительны к bf1
клеточной массе на стадии перед гаструляцией, с (Foxg1) – раннему маркеру клеток конечного
потенциалом развития клеток в три зародышевых мозга эмбрионов (Watanabe et al., 2005). В течение
слоя: энтодерму, эктодерму и мезодерму (Zhang 5 сут клетки в агрегатах формировали непрерыв-
et al., 2001). Затем клетки эмбриоидных тел ком- ный, поляризованный по апико-базальной оси
митируют в нейральном направлении путем до- нейроэпителий, что подтверждалось позитивным
полнения среды для культивирования специфи- иммуногистохимическим окрашиванием клеток
ческими факторами роста и/или ингибиторами. на N-cadherin+. На 7 сут культуру переводили на
Благодаря самоорганизующей способности, ней- среду DMEM/F12 с добавкой N2, где к 10 сут об-
ральные клеточные агрегаты развиваются в орга- разовывалось множество круглых кластеров (да-
ноиды, состоящие из разных нейрональных под- ющих при адгезии розетки) из поляризованных
типов и макроглии, образующих специализиро- нейроэпителиальных клеток с базальным отрост-
ванные области ЦНС (такие как кора, гиппокамп, ком и единственной ресничкой на апикальном
сетчатка, спинной мозг – Eiraku et al., 2011; Mariani конце, которые имели большое сходство с нейро-
et al., 2012; Lancaster et al., 2013; Todd et al., 2013; эпителием и радиальной глией в нормальном эм-
Chichagova et al., 2019; Winanto et al., 2019). В орга- бриональном развитии. Клетки в розетках дели-
ноида химитирующих структуры переднего мозга, лись симметрично и асимметрично, а митотиче-
хорошо воспроизводятся основные особенности ские ядра располагались ближе к апикальной
развивающейся коры: апикально-базальная по- части клеток, как при интеркинетическом движе-
лярность нейроэпителия, интеркинетическая ми- нии ядер в нормальном эмбриогенезе (рис. 2).
грация ядер в нем и РГ, способы деления РГ и ха- Нейрогенез в мЭСК органоидах имел сходство с
рактер миграции нейронов (Mariani et al., 2012). эмбриональным по времени рождения специфи-
Важная особенность церебральных органоидов че- ческих типов клеток из радиальной глии. После-
ловека в том, что в них формируется увеличенная довательно появлялись клетки, несущие марке-
вСВЗ, которая является основной пролифератив- ры будущих слоев коры: Reelin+ (слой I),
ной зоной у приматов, но не у мышей. Tbr1+/Bf1+ (слой VI), Ctip2+/Emx1+ (слой V), и
В литературе выделяют две методологии для Brn2+/Tuj1+ (слой II/III), а время рождения
получения органоидов мозга, которые подразде- нейронов приходилось на 8–10, 9–10, 10–11, и
ляют на “направленную” и “ненаправленную”, 12–13 сутки соответственно. Хотя, в отличие от
что с нашей точки зрения очень условно, по- нормы, в органоидах из мЭСК могла наблюдаться
скольку есть множество разных протоколов для либо инверсия слоев, либо смешанное располо-
получения органоидов. “Ненаправленные” мето- жение клеток всех слоев, их функциональные ис-
ды, главным образом, опираются на способность следования свидетельствовали об активировании
к спонтанному, генетически детерминированно- специфических Ca2+ волн, характерных для нео-
му морфогенезу и внутренней дифференцировке натальных кортикальных тканей. Как пишут ав-
в агрегатах ЭСК и ИПСК (рис. 1). Минимальные торы, они обнаружили интригующую разницу
добавки в композицию среды культивирования между кортикальными тканями, происходящими
дают стволовым клеткам наибольшую свободу от мЭСК и чЭСК. Так, при развитии коры из
ОНТОГЕНЕЗ том 51 №4 2020ЦЕРЕБРАЛЬНЫЕ ОРГАНОИДЫ: МОДЕЛЬ РАЗВИТИЯ МОЗГА 279
Плюрипотентные Церебральный органоид
стволовые клетки
“Ненаправленный”
Агрегация метод
“Регион-специфический” органоид
“Направленный” метод
Эмбриоидные тельца
Сфероид Сфероид
Слияние
Рис. 1. Технологии получения церебральных органоидов. Из плюрипотентных стволовых клеток человека получают
эмбриоидные тельца. Затем, в основном за счет самоорганизации идет образование церебральных органоидов (“нена-
правленный метод”) либо с помощью регуляторных факторов идет формирование “регион-специфических” органо-
идов (“направленный метод”). Сфероиды, представляющие собой разные “регион-специфические” области мозга
могут быть объединены в “ассемблоид”.
мЭСК непрерывный нейроэпителий образует не- новом протоколе в определенные моменты
сколько розеток начиная с 7-го дня культивиро- культивирования, авторы использовали Rho ki-
вания, которые дезорганизовались после 12-го nase ингибитор, повышенный уровень кислоро-
дня по мере уменьшения митозов нейрональных да, Матригель и разные добавки к среде. В ре-
предшественников. В отличие от этого, ткани из зультате, растущий нейроэпителий самопроиз-
чЭСК сохраняли непрерывную нейроэпители- вольно сформировал полярность дорсо-каудальной
альную структуру без розеток даже на 46 сут, что c и вентро-ростральной оси, прошел специфичный
с нашей точки зрения совершенно очевидно, по- морфогенез и образовал полусферическую структу-
скольку нейрогенез в переднем мозгу человека ру с толстой вентрикулярной зоной из Pax6+ и
длиться более 175 сут, а у мышей только 7 сут. Од- Sox2+ клеток, где больше делящихся клеток бы-
нако авторы связывали это с различиями в балан- ло в апикальной части ближе к вентрикулярной
се дифференцировки и самообновления клеток полости, как in vivo. За пределами вентрикуляр-
мЭСК и чЭСК, и с возможным различием в меха- ной зоны в базальной части располагались TuJ1+
нических свойствах клеток между видами (Eiraku нейроны, несущие маркеры ранних нейронов
et al., 2008). кортикальной пластинки Ctip2+, Tbr1+ (Molyneaux
Дальнейшее развитие этой технологий позво- et al., 2007; Hébert, Fishell, 2008). К 70 сут культиви-
лило усовершенствовать методы получения кор- рования в органоиде уже можно четко различить
тикальных органоидов (Kadoshima et al., 2013). В маргинальную зону с Reelin+ клетками Кахаля-Рет-
ОНТОГЕНЕЗ том 51 №4 2020280 СУХИНИЧ, АЛЕКСАНДРОВА
Нейроны
Внешняя
радиальная глия
Интермедиальные
прогениторы
Внутренняя
радиальная глия
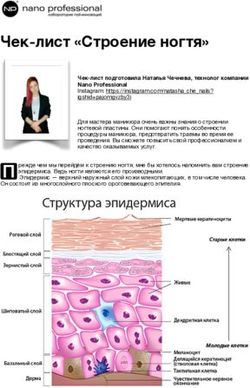
Рис. 2. Формирование ламинарной структуры неокортекса в церебральных органоидах, полученных из ИПСК чело-
века. В начальный период в органоиде образуются 3D розетки, состоящие из клеток нейроэпителия. Далее структура
розеток значительно усложняется из-за пролиферации и миграции клеток, появляются внутренний и внешний слои
радиальной глии, интермедиальные прогениторы, а также слои, состоящие из нейронов.
циуса, нейроны глубоких слоев Ctip2+, Tbr1+, а носительно небольшие нейроэпителиальные ком-
между кортикальной пластинкой (КП) и СВЗ вы- плексы, и их цитоархитектура зачастую не являет-
делялась интермедиальная (промежуточная) зона ся четко определенной, что может быть следстви-
с малым количеством клеток и большим числом ем неадекватных условий культивирования.
нейритов. Непосредственно под кортикальной “Ненаправленный” метод получения нейраль-
пластинкой располагались Calretinin + клетки с ных органоидов из ИПСК человека, который ис-
MAP2+ отростками, которые были сходны с ней- пользовала М. Ланкастер, включает модифика-
ронами субпластинки. Важно, что в течение всего цию среды, использование матригеля и биореак-
времени стволовые клетки сохраняли правиль- тора для поддержания самоорганизации клеток
ную апикально-базальную ориентацию, подобно (Lancaster et al., 2013; Lancaster, Knoblich, 2014). В
радиальной глие в нормальном развитии (Camp- отличие от протоколов “направленной” диффе-
bell, Götz, 2002). К 90 сут культивирования обра- ренцировки, где активировали нейроэктодерму
зовывались нейроны верхних слоев с маркерами подавляя развитие мезодермы и энтодермы инги-
Satb2+ и Brn2+ и кортикальная пластинка стано- биторами SMAD (Chambers et al., 2009), М. Лан-
вилась значительно толще. Авторы подчеркивают кастер инициировала образование церебральных
удивительную самоорганизацию чЭСК, отмечая, органоидов в среде для эмбриональных стволо-
что нейроэпителий самостоятельно (без участия вых клеток с низким уровнем основного фактора
экзогенных морфогенов) образует три нейро- роста фибробластов (bFGF), после чего трехмер-
нальные зоны (субпластинку, кортикальную пла- ные агрегаты переводили на среду для нейраль-
стинку и зону клеток Кахала-Ретциуса), и три ной индукции (с добавками N2 и B27). Общий
прогениторные зоны (желудочковую, субвентри- принцип создания органоидов такой: сначала из
кулярную и промежуточную зону) в том же апи- ИПСК человека формируют эмбриоидные тела с
кально-базальном порядке, что и в коре человека в нейроэктодермой, затем добавляют Матригель
начале второго триместра. В органоиде воспроизво- для формирования 3D структуры и помещают в
дится и следующий этап кортикогенеза, характер- биореактор, который обеспечивает перемешива-
ный для второго триместра, а именно появление на ние среды, улучшает диффузию и трофику орга-
91-й день (13 нед.) предшественников Sox2+ Tbr2+ ноидов. Далее авторы воздействовали на нейро-
клеток внешней радиальной глии внешней СВЗ этодерму малыми молекулами CHIR99021 (CHIR)
(которая характерна для человека, но отсутствует (GSK3 beta inhibitor) в течение 3 сут для актива-
у мышей). Отмечается, что скорость развития ции сигнального пути WNT/β-cathenin; в итоге
кортикальных структур в органоиде в культуре удалось получить только структуры переднего
примерно сравнима с таковой в мозге плода чело- мозга, где почти не было клеток с маркерами
века (Kadoshima et al., 2013). среднего, заднего мозга и мозжечка. Добавление в
Есть представление, что в “направленных” среду Матригеля создавало подобие внеклеточ-
культурах возникают разные типы клеток в отно- ного матрикса и базальной мембраны, которая
сительно постоянной пропорции с меньшей ва- обеспечивала механические свойства, необходи-
риабельностью между партиями органоидов и ис- мые для апико-базальной паттернизации нейро-
ходными клеточными линиями. В тоже время, эпителия и формирования кортикальной пла-
“направленные” органоиды обычно содержат от- стинки, более похожей на ту, которая наблюдает-
ОНТОГЕНЕЗ том 51 №4 2020ЦЕРЕБРАЛЬНЫЕ ОРГАНОИДЫ: МОДЕЛЬ РАЗВИТИЯ МОЗГА 281
ся in vivo (Ranga et al., 2016). Разработанный пользованием PDGF-AA, IGF-1 и тиреоидного
метод позволил М. Ланкастер получить органо- гормона, и созданию “олигокортикальных” сфе-
ид, названный “мини-мозгом”, содержащий сра- роидов (Madhavan et al., 2018). На переживающих
зу ряд областей, включая разные отделы коры, срезах с органоидов с помощью кальциевого ими-
гиппокамп и сетчатку. Важно, что в органоидах джинга и микроэлектродного отведения было по-
переднего мозга последовательно образуются казано, что нейроны физиологически функцио-
структуры коры с четко выраженными слоями, нальны (Jo et al., 2016; Lancaster et al., 2017; Birey
которые на структурном, клеточном и молеку- et al., 2017; Yakoub., 2019) и формируют зрелые си-
лярном уровнях подобны вентрикулярной зоне, напсы (Sakaguchi et al., 2015). Специально для
внешней и внутренней субвентрикулярной зоне и изучения синапсов в органоидах методами имму-
кортикальной пластинке in vivo. В последующем нофлуоресценции были усовершенствованы и
исследователи применили еще одно технологиче- оптимизированы методы визуализации (Yakoub,
ское усовершенствование, которое заключалось в Sadek, 2018, 2019). Тот факт, что физиологическая
использовании нити (филамента) для удлинения активность возбуждающих и тормозных нейро-
эмбриоидных тел и нервной трубки (Lancaster нов в кортикальных органоидах показывает их
et al., 2017). Авторы добавляли в культуру отдель- функциональность, хотя еще и менее зрелую по
ные волокна poly (lactide-co-glycolide) copolymer сравнению с взрослыми нейронами (Pasca et al.,
(PLGA) микрометрового размера, вокруг которых 2015; Birey et al., 2017; Qian et al., 2018; Durens et al.,
формировалась ткань с большой поверхностью, 2020), свидетельствует, что нейроны, образующи-
сохраняя плотные межклеточные контакты и са- еся в органоидах, могут отражать развитие и со-
моорганизацию. В результате, в инженерных це- зревание нейрональных функций на эмбриональ-
ребральных органоидах (enCOR) усиливалось ных стадиях in vivo.
развитие нейроэктодермы, улучшалось формиро-
Одно их первых исследований генетических
вание коры, и в целом полученные структуры уже
характеристик органоидов было проведено
очень напоминали формирующийся мозг челове-
Дж. Мариани с коллегами (Mariani et al., 2012).
ка на стадиях 8–9 недель эмбриогенеза. Цере-
Она, следуя протоколу (Eiraku et al., 2008) для по-
бральные органоиды росли не менее одного–двух
лучении органоидов переднего мозга из ИПСК,
месяцев, и имели разные размеры, в среднем око-
продемонстрировала согласованную активацию
ло 4 мм, а те которые достигали крупного размера
дорсальных теленцефальных генов в органоиде, и
~1 см всегда в центре имели зоны некроза. От-
отсутствие молекул характерных для каудальных
дельные органоиды удавалось поддерживать в
областей. Проведя глобальное сравнение между
культуре около года, что дало возможность изу-
транскриптомами органоидов и образцами эм-
чать последовательные этапы дифференцировки
брионального мозга человека на нескольких эта-
отдельных клеток (Lancaster, Knoblich, 2014).
пах развития, автор выявила поразительное соот-
Важным аргументом в пользу органоидов из кле-
ветствие в экспрессии генов между теленцефаль-
ток человека была демонстрация того, что в них
ными органоидами в 50 сут и корой головного
повторяются уникальные особенности развития
мозга на 8–10 нед. развития. В последние годы,
мозга человека, которые отсутствуют в развиваю-
уже методами полногеномного бисульфитного
щемся мозге грызунов (Lancaster et al., 2013, 2017;
секвенирования (scRNA-seq) церебральных орга-
Bershteyn, Kriegstein, 2013; Pamies et al., 2014; Lan-
ноидов и фетальных тканей коры плода мозга че-
caster, Knoblich, 2014; Otani et al., 2016).
ловека было показано, что кортикальные клетки
Морфологию нервных клеток в наиболее зре- в органоидах используют программы экспрессии
лых органоидах исследовали, используя метод генов, очень похожие на те, что реализуются при
электропорации GFP. Анализ показал, что клет- развитии в ткани мозга плода человека (Camp
ки правильно ориентированы, имеют развитое et al., 2015). Дополняют это данные транскрип-
дендритное древо с ведущим дендритом и общей томного анализа, которые показали, что его ди-
морфологией, характерной для пирамидных кор- намика точно моделирует траектории экспрессии
тикальных нейронов (Lancaster, Knoblich, 2014; генов в мозге плода человека в начальной и сред-
Lancaster et al., 2017). Наряду с этим, в ряде иссле- ней стадии развития (Luo et al., 2016). В работах
дований обращено внимание на то, что в органои- подчеркивается, что в органоидах повторяются
дах формируется большое разнообразие нейронов, многие характерные особенности развития мозга
которое не регулярно повторяется от органоида к человека, и что на этих моделях можно исследо-
органоиду, что ставит вопрос о стандартизации вать и изменения хроматина и генетические меха-
методов культивирования (Quadrato et al., 2017). низмы развития мозга человека (Kanton et al.,
Помимо нервных клеток в органоидах развивают- 2019; Trevino et al., 2020). Эти результаты допол-
ся астроциты (Paşca et al., 2015; Sloan et al., 2017; няются протеомными исследованиями, в кото-
Qian et al., 2018), но редко встречаются олигоденд- рых методами протеомного анализа (label-free
роциты (Monzel et al., 2017). Это привело к отра- shotgun proteomics) проводили сравнение цере-
ботке отдельного метода индукции клеток с ис- бральных органоидов с мозгом плода человека
ОНТОГЕНЕЗ том 51 №4 2020282 СУХИНИЧ, АЛЕКСАНДРОВА
(Nascimento et al., 2019). Авторы выявили более Хотя современные методы позволяют получать
трех тысяч белков, связанных со стадиями диф- ткани, напоминающие различные взаимодейству-
ференцировки нейронов, астроцитов и олиго- ющие между собой области мозга, их пропорция и
дендроцитов. Базовые группы этих белков суще- пространственная организация весьма неодно-
ственны для развития коры мозга, они участвуют родны и непредсказуемы. Чтобы улучшить моде-
в нейрогенезе, направленном росте аксонов и си-
наптогенезе, а белки глиальных клеток ответ- лирование межрегиональных взаимодействий,
ственны за поддержание клеток, энергетический несколько групп исследователей одновременно
обмен, межклеточные связи и передачу сигналов. разработали оригинальный подход. Сначала из
Профиль изученных белков в органоидах в значи- плюрипотентных стволовых клеток, по отдель-
тельной степени повторял таковой при нормаль- ности, получают органоиды определенных об-
ном развитии мозга плода человека. ластей мозга, которые затем соединяют вместе
Фундаментальное значение имеют исследо- (Bagley et al., 2017; Birey et al., 2017; Xiang et al.,
вания церебральных органоидов человека с по- 2017). Например, при ассоцииации органоидов
зиции эволюции мозга, поскольку их сравнение дорсального и вентрального переднего мозга
с органоидами других приматов может выявить формируются “ассемблоид” с двумя отличными
молекулярные пути, лежащие в основе уни- доменами (рис. 1) (Birey et al., 2017), между кото-
кальных специализаций человеческого мозга.
Пионерские работы, проведенные в этом на- рыми возникают определенные клеточные взаимо-
правлении, выявили в органоидах человека бо- действия. Так, рожденные в вентральном домене
лее двухсот дифференциально экспрессируе- тормозные ГАМК-ергические интернейроны ми-
мых генов, обогащенных недавней дупликацией грировали преимущественно в направлении дор-
генов и включающих множественные регулято- сального домена, где доминируют возбуждающие
ры сигнальных путей PI3K-AKT-mTOR, что от- глютаматергические нейроны. Поведение клеток
личает их от органоидов мозга шимпанзе и ко- имитировало тангенциальную миграцию интер-
ры макак (Pollen et al., 2019). Это важное на- нейронов в нормально развивающейся коре моз-
правление требует выработки стратегии для га in vivo (Anderson et al., 2001). Можно полагать,
определения эволюционных различий между
человеком и другими приматами, в основу ко- что получаемые на основе плюрипотентных ство-
торой может быть положен анализ молекуляр- ловых клеток человека ассемблоиды могут стать
ных изменений, способствовавших эволюции че- моделью для изучения клеточных взаимодействий
ловеческого мозга, проявляющихся в цере- и перекрестных связей, которые существенны как
бральных органоидах (Giandomenico, Lancaster, для нормального развития мозга, так и при разви-
2017; Heide et al., 2018; Pollen et al., 2019; Mostajo- тии его заболеваний (Marton, Pașca, 2019).
Radji et al., 2019; Muotri, 2019).
Особый интерес представляют эксперименты
с формированием аксональных связей между раз-
БИОЛОГИЧЕСКИЕ КОНСТРУКЦИИ ными типами церебральных органоидов. Первый
ИЗ ЦЕРЕБРАЛЬНЫХ ОРГАНОИДОВ пример in vitro выращенных длинных кортикаль-
Авторы признают, что церебральные органо- ных аксонных трактов между органоидами мозга
иды не полностью моделируют организацию человека представлен в работе Каллена с колле-
мозга. В них достаточно случайным образом гами (Cullen et al., 2019). Авторы собрали ком-
формируются разные клеточные комплексы, без плекс из двух органоидов, представляющих раз-
нормального их взаимодействия, дающего взаи-
моподчиненные структуры в норме. В отличие ные отделы коры, между которыми поместили
от нормального развития, где из единственной специальные гидрогелевые микроколонки,
нейроэпителиальной трубки развивается вся предназначенные для поддержания и направле-
центральная нервная система, в органоидах воз- ния роста аксонов. В результате была сформи-
никает несколько нейроэпителиальных комплек- рована достаточно “жесткая” биоинженерная
сов (объемных розеток), каждый из которых дей- конструкция с аксональными трактами длиной
ствует как независимый центр морфогенеза. Эти до 1 см, которая допускала физические манипу-
особенности морфогенеза ставят вопрос об усо- ляции, необходимые для ее трансплантации в
вершенствовании методов культивирования ор- мозг. Авторы обращают внимание на то, что ра-
ганоидов с целью получения более стандартизи-
рованных структур. Поэтому в многих лаборато- бота представляет собой первый шаг к возмож-
риях ведется разработка новых методов и ности реконструкции мозга с помощью специ-
технологических подходов, направленных на ре- фичной для пациента, выращенной in vitro корти-
шение этих задач (Knight et al., 2018; Yakoub, кальной ткани с длинными аксонными трактами
Sadek, 2018: Qian et al., 2018; Eremeev et al., 2019). (Cullen et al., 2019).
ОНТОГЕНЕЗ том 51 №4 2020ЦЕРЕБРАЛЬНЫЕ ОРГАНОИДЫ: МОДЕЛЬ РАЗВИТИЯ МОЗГА 283
РОЛЬ ЦЕРЕБРАЛЬНЫХ ОРГАНОИДОВ плода для изучения эффектов воздействия вируса
В ИЗУЧЕНИИ ПРИРОДЫ Зика. После того как в культуру добавляли вирус
ПАТОЛОГИЧЕСКИХ НАРУШЕНИЙ Зика на сутки, было обнаружено, что церебраль-
МОЗГА ЧЕЛОВЕКА ные органоиды развивались значительно мень-
шего размера. В них происходило уменьшение
Органоиды головного мозга, полученные из ин- толщины и размера ростовой вентрикулярной зо-
дуцированных плюрипотентных стволовых клеток ны из-за клеточной гибели и подавления проли-
пациентов, используются для моделирования рас- ферации. Выяснилось, что вирус Зика локализо-
стройств головного мозга, связанных с развитием вался в незрелых нейронах и астроцитах, однако
нервной системы (Chen et al., 2019; Qian et al., 2019), специфический тропизм вирус проявлял к НСК,
для проверки эффектов лекарственных средств включая клетки вРГ, что, вероятно, и являлось
(Aasen, Vergara, 2020) и токсинов на нервные клетки причиной патологии развития мозга (Qian et al.,
(Chhibberet al., 2020). Прогресс, достигнутый в фор- 2016, 2017, 2019).
мировании органоидов мозга, имеет исключитель-
ную важность для изучения природы распростра- Церебральные органоиды были использованы
ненных нарушений развития мозга человека. Меха- для изучения механизмов проявления синдрома
низмы развития патологий часто ищут в изменении Дауна, при котором одной из причин когнитив-
регуляции клеток-предшественников, включая их ных нарушений является дисбаланс возбуждающей
преждевременную дифференцировку, сниженную и тормозной активности кортикальных нейронов.
пролиферацию или нарушение клеточного цикла, Как известно, много тормозных ГАМК-ергических
что можно, в определенных пределах, исследовать интернейронов возникает и мигрирует в развиваю-
на церебральных органоидах. щуюся кору из нейроэпителия вентральной части
переднего мозга (Anderson et al., 2001), где у челове-
Одно из первых нарушений развития мозга че- ка экспрессируются транскрипционные факторы
ловека, исследованных на церебральных органо- OLIG1 и OLIG2 (Barber, Pierani, 2016). Авторы об-
идах была микроцефалия – патология, при кото- наружили, что в органоидах, полученных из клеток
рой заметно уменьшается размер мозга (Lancaster пациентов с синдромом Дауна, присутствует из-
et al., 2013). Микроцефалия связана с аутосомно- быточное количество OLIG2+ клеток. Эти клет-
рецессивными мутациями в нескольких генах, ки генерируют увеличенное число определенных
каждый из которых кодирует белки, локализую- типов ГАМК-ергических интернейронов, из-за
щиеся в аппарате митотического веретена (Me- чего в коре может нарушаться баланс возбуждаю-
graw et al., 2011). До недавнего времени патогенез щих и тормозных нейронов и приводить к эпи-
микроцефалии исследовался на мышиной моде- лептиформной активности (Xu et al., 2019). На ор-
ли, где так и не удалось воспроизвести сильно ганоидах, полученных от пациентов с синдромом
уменьшенный размер мозга. В противополож- Ангельмана, удалось показать, что в основе эпи-
ность этому, микроцефальные органоиды чело- лептической нестабильности у больных лежит
века имели выраженное уменьшение размеров в дисфункция калиевого канала, которую вызыва-
сравнении с контрольными образцами. В органо- ют нарушения в гене убиквитин-белковой лигазы
идах уменьшался слой нейроэпителия и клеток E3A (UBE3A) (Sun et al., 2019). В дополнение, ор-
радиальной глии и одновременно обнаружива- ганоиды использовали для моделирования геми-
лось большее число нейронов. Это свидетель- ческого повреждения коры головного мозга, ко-
ствовало об их преждевременной дифференци- торое развивается вследствие человеческой цере-
ровке нейронов, что могло объяснять изменение бральной малярии, и для тестирования лекарств,
размера мозга (Lancaster et al., 2013). Нарушения снижающих повреждение головного мозга и нев-
касались и ориентации веретена деления клеток рологические осложнения при малярии (Harbu-
радиальной глии, что так же могло приводить к zariu et al., 2019).
снижению числа симметричных делений и нару- Нужно отдавать себе отчет в том, что большин-
шению нейрогенеза. На органоидах было выявле- ство нейродегенеративных заболеваний проявля-
но, что на клеточном уровне микроцефалия у че- ются у взрослых и пожилых людей, вследствие чего
ловека, скорее всего, опосредуется снижением органоиды, имитирующие эмбриональное разви-
продукции прогениторных клеток и преждевре- тие мозга, могут не подходить для моделирования
менной дифференцировкой нейронов, что в сум- их патогенеза. Тем не менее, в настоящее время в
ме приводит к уменьшению размеров мозга. изучении патогенеза многих нейродегенератив-
Недавние клинические исследования обнару- ных процессов получили важную роль исследо-
жили, что вызвать микроцефалию может вирус вания, связанные именно с развитием нервной
Зика, который во время беременности может системы, поэтому органоиды могут быть полез-
проходить через плаценту и получить доступ к ны и для патологий, проявляющихся с возрас-
развивающемуся мозгу плода (Driggers et al., 2016; том (Faravelli et al., 2020). Удивительным образом,
Mlakar et al., 2016). Поэтому органоиды были ис- но уже в органоидах, созданных на основе клеток
пользованы как модель разных стадий развития пациентов с болезнью Альцгеймера, проявляются
ОНТОГЕНЕЗ том 51 №4 2020284 СУХИНИЧ, АЛЕКСАНДРОВА
такие характерные возрастные патологические мый паттерн экспрессии белка наблюдался только в
признаки, как накопление амилоидных бляшек и 3D органоидной модели мозга, но не в двумерных
нейрофибриллярных клубков, что позволяет их ис- клеточных культурах нейронов (Dakic et al., 2017).
пользовать как модельные системы (Raja et al., В другой работе церебральные органоиды челове-
2016; Seo et al., 2017; Gonzalez et al., 2018). На орга- ка использовали для изучения пренатального
ноидах можно частично моделировать даже бо- влияния метамфетамина на развитие мозга плода.
лезнь Паркинсона. Известно, что допаминовые Исследование с использованием одноклеточного
нейроны, дифференцированные из человеческих РНК-секвенирования (scRNA-seq) показало из-
плюрипотентных стволовых клеток в адгезивных менения транскрипции в астроцитах и нейрон-
условиях in vitro, не повторяют некоторых осо- ных предшественниках. Авторы обнаружили по-
бенностей нейронов среднего мозга in vivo. Напри- вышенную регуляцию генов раннего ответа, фак-
мер, они не продуцируют пигмент нейромеланин, торов комплемента, апоптоза и генов иммунного
если только “старение” не вызвано искусственно, ответа, что указывало на активацию нейровоспа-
посредством экспрессии ассоциированного с забо- лительного ответа регулирующего пролифера-
леванием прогерина (Miller et al., 2013). Исходя из цию, дифференцировку и гибель нервных ство-
этого, был разработан протокол получения орга- ловых клеток. Метамфетамин-индуцированные
ноидов среднего мозга, в которых развивались изменения в экспрессии нейровоспалительных и
клетки экспрессирующие нейромеланин, струк- цитокиновых генов, показанные на уровне РНК
турно сходный с выделенным из черной субстан- и белка, свидетельствовали, что органоиды чело-
ции мозга человека (Jo et al., 2016). Показано также, века представляют собой модельную систему для
что органоиды среднего мозга, в которых развива- изучения лекарственно-индуцированного воспа-
ются TH-позитивные допаминергические нейро- ления в ЦНС (Dang et al., 2020).
ны, при фармакологической индукции нейродеге- Органоиды можно применять и в другой сфе-
нерации могут служить подходящей моделью бо- ре, исследовать на них нейротоксичность, напри-
лезни Паркинсона (Qian et al., 2016; Jo et al., 2016; мер, моделировать воздействие тяжелых метал-
Monzel et al., 2017). Считается, что исследование ор- лов на плод (Chhibber et al., 2020). Кроме того, ор-
ганоидов, полученных от пациентов с болезнью ганоиды используют и для получения и изучения
Паркинсона, может дать уникальную возмож- опухолей, без трансплантации опухолевых клеток
ность непосредственно исследовать патогенные лабораторным животным (Chenetal., 2019).
механизмы и тестировать лекарственные соеди-
нения в нейронах человека (Marotta et al., 2020).
С целью изучения развития нервно-мышеч- ОСОБЕННОСТИ ТКАНЕВОЙ
ных патологий, например, миастении были раз- ОРГАНИЗАЦИИ ОРГАНОИДОВ, ПРОБЛЕМА
работаны методы получения нервно-мышечных ВАСКУЛЯРИЗАЦИИ, И ВОЗМОЖНОСТЬ
органоидов в которых развиваются функцио- ИХ ТРАНСПЛАНТАЦИИ IN VIVO
нальные нервно-мышечные соединения в ком- Определенно, что церебральные органоиды,
плексе с Шванновскими клетками. Использова- имитирующие ряд аспектов нейрогенеза мозга
ние таких органоидов даст возможность модели- человека, подобно всем другим модельным си-
ровать нервно-мышечных заболевания в будущем стемам, имеют ряд ограничений. Одна из про-
(Faustino Martins et al., 2020). блем связана с тем, что в церебральных органоидах
Церебральные органоиды человека могут пред- практически отсутствуют мезенхимные клетки, в
ставлять интересную модельную систему для изуче- частности микроглия и эндотелиоциты, которые
ния широкого спектра лекарственных препаратов. необходимы для нормального развития и функци-
На них были изучены эффекты галлюциногенной онирования нервной ткани. Клетки микроглии,
молекулы 5-метокси-N,N-диметилтриптамина происходящие от эритромиелодных предшествен-
(5-MeO-DMT) на белковый состав 45 сут цере- ников желточного мешка, в раннем эмбриогенезе
бральных органоидов человека (Dakic et al., 2017). заселяют мозг и, являясь медиатором воспаления,
После воздействия 5-МеO-DMT в течение 24 ч, выполняют иммунную функцию при повреждении
из 6728 идентифицированных белков 934 экс- и нейродегенерации. О значении васкуляризации
прессировались отличным от контроля образом. нет смысла говорить, поскольку очевидно, что
В опытных органоидах снижалась регуляция сиг- без развития сосудистой системы жизнеспособ-
нальных путей NFAT и NF-kB, что свидетельство- ность церебральных органоидов резко ограниче-
вало о противовоспалительных эффектах, и наблю- на. К решению этой “тканевой” проблемы подо-
далась модификация белков связанных с организа- шли следующим образом, использовали раздель-
цией микротрубочек и цитоскелета, участвующего ное культивирование клеток микроглии или
в формировании дендритных шипиков. О защит- эндотелиальных клеток, после чего их соединяли
ной функции препарата свидетельствовало сниже- с мозговыми органоидами. Интересен пример со-
ние белков клеточной гибели и путей нейродегене- культивирования изогенных микроглиоподоб-
рации. Интересно, что этот лекарственно-зависи- ных клеток с органоидами дорсального переднего
ОНТОГЕНЕЗ том 51 №4 2020ЦЕРЕБРАЛЬНЫЕ ОРГАНОИДЫ: МОДЕЛЬ РАЗВИТИЯ МОЗГА 285
мозга. В результате миграции микроглии внутрь ло формирование четко выраженных нейроэпи-
органоидов в них усиливалась иммунная функ- телиальных слоев и желудочковых зон. Крове-
ция, активировалась передача сигналов mTOR и носные сосуды хозяина проникали на 7–10 день,
p53, повышалась экспрессия лигандов Notch, ак- и органоиды становились сильно васкуляризо-
тивировалась репрессия NF-κB и канонических ванными на 14 день. С помощью двуфотонной
путей Wnt (Bejoy et al., 2019). Кроме сокультивиро- микроскопии авторы показали, что через сосуды
вания, путем манипулирования разными добавка- идет активный кровоток, и ткани органоида
ми к среде культивирования (bFGF, ROCK-inhibi- снабжаются кровью. Отдельные трансплантаты,
tor Y-27632, neural induction medium) оказалось выжившие до 233 сут (последний срок, протести-
возможным получить церебральные органоиды с рованный в исследовании), показали постоян-
микрогиальными клетками, которые развивались ную экспрессию в нейронах NeuN и SOX2. Число
из мезенхимных закладок одновременно с ней- меченых hGFAP астроцитов, которых до транс-
ральными клетками (Ormel et al., 2018). Авторы плантации в органоидах было минимально, после
отмечают, что иммунологическая микросреда, интеграции значительно возрастало со временем.
приближенная к нормальной за счет ассоциации Кроме того, на средних и поздних сроках, в транс-
микроглии в кортикальные органоиды in vitro, плантированных органоидах были выявлены оли-
позволит намного лучше воспроизводить функ- годендроциты Olig2+, однако миелинизации не
цию мозговой ткани in vivo, что необходимо для было обнаружено. О формировании синаптиче-
адекватного моделирования заболеваний и скри- ских контактов в трансплантированном органоиде
нинга лекарств (Ormel et al., 2018; Bejoy et al., свидетельствовала колокализация преснаптиче-
2019). ского маркера Synapsin I и постсинаптического
Подобным образом эндотелиальные клетки PSD95. Микроглия Iba1 мигрировала из ткани
можно культивировать отдельно и добавлять к мозга хозяина в органоид. На 90 сутки обнаружи-
органоидам на стадии формирования эмбриоид- вался обширный рост аксонов GFP+ человека из
ных тел, что дает возможность эндотелиоцитам органоида, и волокна распространялись в обоих
самоорганизоваться с образованием сетчатых полушариях мозга мыши, хотя в ипсилатераль-
структур (Nzou et al., 2018; Pham et al., 2018). ном их было значительно больше. Кроме того,
Кроме того, рост сосудов можно индуцировать обнаруживались синапсы между нейронами че-
добавкой в эмбриоидные тела фактора роста эн- ловека и мыши. Функциональную активность
дотелия сосудов (VEGF), который активирует нейронов трансплантатов подтвердили, исполь-
дифференцировку эндотелиальных клеток, не зуя кальцевый имиджинг, методы оптогенетики и
блокируя нейрональную дифференцировку. В ре- электрофизиологии.
зультате успешно развиваются церебральные ор- В другом исследовании церебральные органо-
ганоиды с сосудистыми структурами, клетки ко- иды из ИПСК человека сокультивировали с эн-
торых экспрессируют маркер эндотелия CD31 и дотелиальными клетками, выращенными от того
маркер плотных контактов клаудин-5, характери- же донора (Harding et al., 2017; Pham et al., 2018).
зующий гематоэнцефалический барьер (Ham Затем “васкуляризованные” органоиды транс-
et al., 2020). Хотя примитивные эндотелиальные плантировали в полость в коре мозга иммуноде-
сети оказались неспособными нормально функ- фицитных мышей. Через две недели в некоторых
ционировать и обеспечивать доставку питатель- органоидах наблюдалась сильная васкуляризация
ных веществ в органоиды, сами эти исследования вплоть до центра, а неваскуляризованные органо-
дают потенциальную платформу для моделирова- иды не переживали. После трансплантации чело-
ния нейроваскулярной ниши и гематоэнцефали- веческие CD31-позитивные кровеносные сосуды
ческого барьера (Nzou et al., 2018; Pham et al., 2018; сохранялись внутри и в центре органоида, что
Ham et al., 2020). свидетельствовало о том, что васкуляризация ор-
Очевидно, что в органоиде по мере генерации ганоидов головного мозга с помощью ИПСК, по-
большого числа нейронов кортикальная пластин- лученных от того же пациента, технически воз-
ка утолщается и отсутствие васкуляризации ухуд- можна. Недостатком этого исследования являет-
шает выживаемость клеток, ограничивается раз- ся то, что авторы не доказали ни связь между
мер органоида и нарушает общую структуру ткани капиллярами в органоидах человеческого мозга и
(Shen et al., 2004; Yin et al., 2016). Для васкуляриза- мозгом мыши хозяина, ни перфузию человече-
ции органоида была предпринята имплантация в ских капилляров кровью грызунов (Pham et al.,
живой мозг с целью провоцирования их васкуля- 2018). Иную цель преследовала работа (Daviaud
ризации для долгосрочного выживания (Mansour et al., 2018), где из чЭСК в культуре получали и
et al., 2018). Трансплантированные в полость, сде- НСК и церебральные органоиды, которые транс-
ланную в коре головного мозга иммунодефицит- плантировали в виде суспензии, либо целиком в
ных мышей, GFP чЭСК органоиды интегрирова- кору постнатальных (П8-10) мышей. Сравнивали
лись, и 80% из них переживало не менее 120 сут. выживаемость трансплантатов, их васкуляриза-
Их отличительной морфологической чертой бы- цию, пул НСК и дифференцировку через две и
ОНТОГЕНЕЗ том 51 №4 2020286 СУХИНИЧ, АЛЕКСАНДРОВА
четыре недели после трансплантации. Транс- ЗАКЛЮЧЕНИЕ. ОГРАНИЧЕНИЯ
плантаты НСК значимо уменьшались в размерах И ПЕРСПЕКТИВЫ В ИССЛЕДОВАНИИ
в интервале от двух до четырех недель после пере- ЦЕРЕБРАЛЬНЫХ ОРГАНОИДОВ
садки, тогда как размеры церебральных органои- Моделирование процесса формирования моз-
дов оставались стабильными в течение этого пе- га путем построения его органоидов открывает
риода, что подтверждало их лучшую интеграцию перспективы изучения механизмов раннего эм-
в сравнении с суспензированными клетками. Че- брионального развития в норме и при патологии,
рез 2 недели в обоих видах трансплантатов хозяй- которые представляют особую проблему для че-
ских Iba1 клеток микроглии было мало, но через ловека. До настоящего времени морфология и
4 нед. микроглии было много вокруг трансплан- развитие человеческого мозга не могут быть пол-
тата суспензии, хотя у органоида их было относи- ностью воспроизведены на животных моделях, а
тельно немного. Васкуляризацию изучали по геномные, метаболические и биохимические раз-
маркеру эндотелиальных клеток CD31, и обнару- личия ограничивают прогностическую возмож-
ность трансляционных исследований. За послед-
жили множество капилляров в органоиде, враста- ние годы были достигнуты значительные успехи в
ющих со стороны реципиента уже через две неде- разработке методов культивирования 3D органо-
ли. В результате оказалось, что в сравнении с идов мозга человека. Несомненное преимуще-
трансплантатом суспензированных НСК, орга- ство органоидов, полученных из ЭСК или ИСПК
ноиды лучше переживают и интегрируются, в них человека, состоит в том, что в них воспроизводятся
больше DCX+ и NF+ нейронов, и лучше выраже- уникальные особенности развития человеческого
ны собственные астроциты и олигодендроциты мозга, которые отсутствуют в развивающемся мозге
(Daviaud et al., 2018). грызунов. Способность ЭСК и ИПСК к самоорга-
низации в процессе нейрализации, и повторение
В следующих работах церебральные органои- алгоритмов, свойственных нормальному развитию,
ды уже использовали для трансплантации в мозг делает органоиды уникальной моделью развития
после инсульта (Wang et al., 2019). Авторы подса- мозга человека. Тем не менее, органоиды из кле-
живали органоид в мозг крыс через 6 ч или даже ток мыши, по-прежнему играют важную роль,
24 ч после окклюзии средней мозговой артерии, и поскольку они могут использоваться для сравни-
показали значительное уменьшение объема ин- тельных исследований человеческих органоидов
фаркта мозга и улучшение двигательной функ- и разработки предварительных протоколов куль-
ции. Это пилотное исследование показало, что тивирования для получения специфичных обла-
потенциально органоиды могут быть использова- стей мозга (Marshall, Mason, 2019). Несмотря на
всю привлекательность органоидных моделей,
ны для терапии при лечении инсульта. очевидно, что на данном этапе существующие
Суммируя работы по трансплантации цере- ограничения препятствуют их использованию в
бральных органоидов человека в мозг грызунов, определенных направлениях. Так, например, су-
необходимо обратить внимание на то, что основой ществует много методов получения органоидов,
органоидов являются малодифференцированные но не один из них не позволяет получать стабиль-
но повторяющиеся структуры из-за спонтанной
клетки, обладающих огромным потенциалом раз- дифференцировки клеток. В органоидах развер-
вития, находящиеся в архитектурно целостном тываются ранние этапы развития мозга, в то вре-
комплексе. В органоидах прекрасно развит внекле- мя как более поздние стадии развития, характе-
точный матрикс, являющийся источником нерас- ризующиеся ростом нервных волокон и форми-
творимых и растворимых белков с нейротрофина- рованием высших функций нейронной сети, не
ми, факторами роста, навигации и т.д. Именно это могут быть адекватно воспроизведены в этих
дает органоидам преимущество перед суспензиро- структурах. Кроме того, технологии получения
ванными НСК в интеграции при трансплантации органоидов не лишены недостатков и ограниче-
в полость мозга. Целостные органоиды из-за ний, например, в них не происходит дифферен-
большого объема пересаживают в заранее приго- цировка сосудов и капиллярной сети, обеспечи-
товленную полость в мозге. Однако можно пред- вающих трофическую поддержку ткани мозга, и,
положить, что еще лучше органоид будет разви- в ряде случаев, играющих роль скаффолда при
миграции клеток. Точно так же клетки микро-
ваться в естественных полостях мозга, например, глии, которые происходят из эритромиелодных
в боковых желудочках (Pothayee et al., 2018), чему предшественников желточного мешка и заселяют
будет способствовать цереброспинальная жид- мозг в раннем эмбриогенезе, отсутствуют в орга-
кость, которая служит важным компонентом ни- ноидах, хотя их роль как медиатора воспаления и
ши НСК и важна для поддержания пролифера- одного из ключевых игроков при повреждении и
тивной активности и дифференцировки ранних нейродегенерации чрезвычайно важна. Кроме
клеток-предшественников (Lehtinen et al., 2011). того, существуют некоторые этические пробле-
ОНТОГЕНЕЗ том 51 №4 2020Вы также можете почитать